Slik skal du gjøres frisk i framtiden.
Moderne medisin ville virket mirakuløs for mennesker som levde for mindre enn 100 år siden, men framskrittene vi har foran oss, er enda mer fantastiske. Forskere og ingeniører fra et bredt spekter av fagområder fører nå sammen sine siste framskritt og skaper en rekke nye medisinske teknologier som totalt forandrer måten vi diagnostiserer, behandler og til og med kurerer sykdom på.
Nanoteknologi bringer medisinen ned på molekylnivå og retter seg inn mot de ørsmå mekanismene som holder kroppen i gang, mens stamceller forsyner oss med en fornybar kilde til erstatninger for hver eneste celle i kroppen. Personlig tilpasset medisin er lovende med tanke på å skreddersy behandlinger etter hver pasients genetiske profil, og framskritt innen nevrovitenskap, databehandling, robotikk og elektronikk gjør det mulig for avanserte proteser å reagere direkte på kommandoer fra hjernen. Vaksiner kan en dag settes smertefritt gjennom tusenvis av mikroskopiske doser, mens tilpassede vitaminkombinasjoner eller medisiner kan printes som praktiske piller til daglig bruk.
Vi kan ikke vite med sikkerhet hvilke av dagens banebrytende teknikker man vil bruke i klinikkene i framtiden, men når teknologien utvikles så fort, kan vi vente oss flere medisinske mirakler før vi ser et nytt tiår.
Nanomedisin
Molekylmaskineriet som holder kroppen i gang, er bygget i en nanometer-målestokk. Hemoglobinmolekyler (proteinene som frakter oksygen i blodet) har en diameter på omtrent 5 til 7 nanometer – det er rundt 10 000 ganger mindre enn tykkelsen på et menneskehår.
Nanomedisinen forsøker å samhandle med denne miniatyrverdenen med materialer som har et tverrmål på mindre enn 1000 nanometer. På en så liten skala håper forskerne å utvikle nanoteknologi med høy presisjon som kan reparere eller erstatte ødelagte cellekomponenter.
Nanomaterialer finnes allerede i klinikkene, der de brukes til å lage kapsler som kan frakte små «pakker» med medisin inn i kroppen. Noen kapsler beskytter medisinen mot å brytes ned på veien til riktig sted i kroppen, andre bidrar som veivisere, slik at behandlingen når målet.
Regenerering av skadet vev
Stamceller har en utrolig evne til regenerering og potensial til å erstatte hver eneste celle i kroppen. Flesteparten av cellene i kroppen er svært spesialiserte. Hver av dem er tilpasset en rolle, og når de har bundet seg til å bli en bestemt celletype, er det permanent. Men stamceller har ennå ikke spesialisert seg. I stedet reparerer de og bidrar til vekst, og de kan fortsette å lage kopier av seg selv lenge etter at de fleste moderceller har sluttet å dele seg. Hver av disse kopiene kan hvile, lage flere kopier eller begynne å utvikle seg til spesialiserte celler.
Hvilken spesialisering stamcellen velger, varierer ut fra hvilke signaler den mottar, og avhenger av hvilken type stamcelle det er – en embryonal stamcelle eller en av de mange variantene av moderceller. Embryonale stamceller har de største mulighetene. De finnes i fostre under utvikling, og med de rette signalene kan de omdannes til hvilken som helst av kroppens celletyper.
Med disse utrolige egenskapene er det ikke rart stamceller vies så mye oppmerksomhet fra forskermiljøene. Leger utfører allerede stamcelletransplantasjoner for å erstatte tapt beinmarg, og stamceller brukes også til hudnett for transplantasjon. I framtiden håper man å reparere skadet vev inne i kroppen og til og med gjenoppbygge hele organer med stamceller.
Kur mot blindhet
Kan stamceller brukes til å gjenskape synet? The London Project to Cure Blindness er et samarbeid mellom Moorfields Eye Hospital, University College London, University of Sheffield, britiske myndigheter og legemiddelfirmaet Pfizer. Man sikter mot å bekjempe sykdommen «våt aldersrelatert makula degenerasjon» (AMD), som gir hurtig tap av sentralsyn.
Teamet bruker stamceller til å dyrke flak av retinale pigmentepitelceller (RPE). Disse cellene danner et brunfarget lag på øyets bakside, noe som bidrar til å absorbere spredt lys og dermed hjelpe synet. Cellene beskytter og gir næring til stavene og tappene som reagerer på lys som kommer inn i øyet. RPE-cellelaget kan bli skadet ved våt AMD, så teamet har brukt stamceller til å dyrke en lapp med nye RPE-celler for å erstatte dem.
I laben oppfører de nye cellene seg akkurat som de opprinnelige, og i 2015 mottok den første pasienten denne nye behandlingen som ledd i et klinisk forsøksprosjekt. De endelige resultatene av den to timer lange operasjonen er ennå ikke kjent, men ytterligere ni pasienter blir testet for å finne ut om denne pionerbehandlingen er trygg, og det som er aller viktigst – om den virker. I framtiden håper teamet å kunne bruke stamceller til å dyrke nye celler til staver og tapper, slik at skader på øyets lysømfintlige maskineri kan repareres.
Kampen mot superbakterier
Skal vi overleve framtidige infeksjoner, må vi kunne håndtere antibiotikaresistens. Akkurat som mennesker har bakterier genetiske variasjoner som gir dem litt ulike egenskaper. Dette betyr at noen bakterier bukker under for antibiotika fortere enn andre. Hvis de mer hardføre bakteriene overlever til antibiotikakuren er over, kan de bestå og skape en hel koloni med de samme genetiske fortrinnene. Antibiotikaen du tok tidligere, vil ikke lenger ha noen virkning på infeksjonen. Jo mer antibiotika som brukes, desto oftere gjentas denne syklusen, og det blir flere bakteriestammer som kan motstå noen av våre sterkeste legemidler. Enda mer urovekkende er det at antibiotikaresistente gener kan overføres mellom bakterier, og også mellom arter.
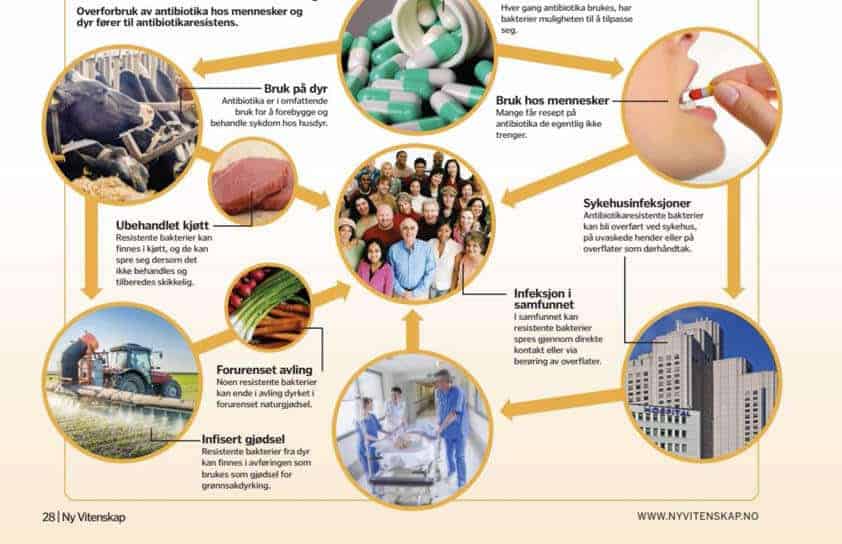
De resistente bakteriene spres.
Personlig medisin
I framtiden vil behandlinger skreddersys til din unike genetiske profil. De genetiske ulikhetene som gjør oss alle unike, bestemmer også hvordan vi reagerer på medisinsk behandling. Genetiske egenskaper hos bakterier og virus bestemmer også deres reaksjon på ulike stoffer. Rustet med innsikt i genetikken bak disse reaksjonene beveger vi oss mot en tid hvor behandlingen kan tilpasses personlig til hver enkelt pasient. Dette er skritt som allerede er tatt innenfor presisjonsbehandling av kreft, hvor genetiske ulikheter i kreftcellene spiller en viktig rolle for hvorvidt de forskjellige behandlingene vil virke.
Framtidens vaksiner
Immunforsvaret bekjemper sykdommer langt mer effektivt hvis det har støtt på dem før. De fleste vaksiner lages av en svekket eller deaktivert utgave av patogenet, eller bare noen deler av det. Disse sprøytes inn i kroppen sammen med kjemikalier som kalles «adjuvanter», og disse får immunforsvaret i gang. Infeksjonen tar aldri tak, men etter hvert som immunforsvaret arbeider for å fjerne vaksinestoffene, utvikles det et svært målrettet arsenal som kan brukes til å bekjempe den virkelige sykdommen.
Denne typen vaksiner har forandret verden. Kopper ble utryddet i 1980 etter et vaksinasjonsprogram, og vaksiner holder en mengde andre smittsomme sykdommer i sjakk. Nye teknikker utvikles nå for å bringe denne beskyttelsen ett steg videre. «Rekombinante virusvektorvaksiner» kaprer virus og bruker dem som redskap. Virus injiserer sin genetiske informasjon i cellene, men gjennom genteknologi kan forskere slette genene som gjør dem farlige, og erstatte dem med noe nyttig. Ved bruk av denne teknikken kan harmløse virus skapes for å bringe opplæringsmateriale inn i kroppen, for å lære immunforsvaret hvordan det skal bekjempe infeksjoner og til og med ikke-smittsomme sykdommer som kreft.
En liknende teknikk som heter DNA-vaksinasjon, går ut på å sprøyte genetisk informasjon i muskelen (vanligvis festet til for eksempel mikroskopiske gullperler). Disse genene bærer instrukser om å danne molekyler som finnes i infeksjoner, slik at immunforsvaret kan få en sniktitt før den virkelige sykdommen skal møtes.

Smertefrie injeksjoner: Vaxxas Nanopatch er en kvadratcentimeter med silikon som omgir rundt 20 000 mikroskopiske injeksjoner. Nålene er så små at du ikke kan se dem, og hver nålespiss er dekket med vaksinen.