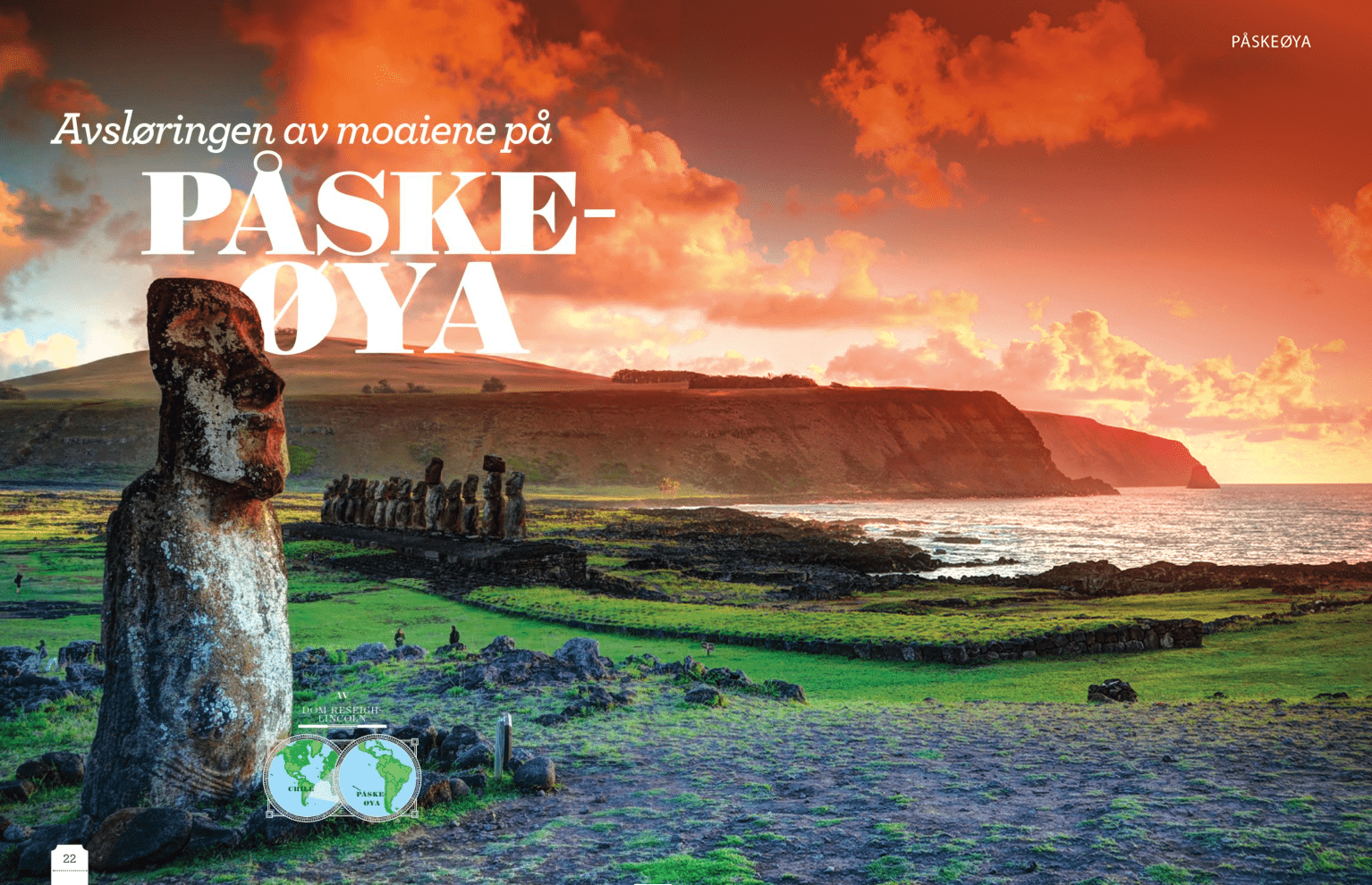Den fargeløse kjemikalieforbindelsen er selve nøkkelen til livet.
Et vannmolekyl består av bare tre atomer – ett oksygen – og to hydrogenatomer. Det er mindre enn et karbondioksidmolekyl, og med tanke på størrelsen burde det egentlig flyte rundt som en gass ved romtemperatur. Men vannmolekylene klarer å holde seg samlet som en væske. Molekylene binder seg til hverandre med det vi kaller hydrogenbindinger.
Kjemien i vannet innebærer at én side av molekylet er positivt ladet og den andre siden er negativt ladet. Når et molekyl kommer i nærheten av et annet, vil ladninger med motsatt fortegn tiltrekkes av hverandre, og de fester seg midlertidig. De danner mange slike hydrogenbindinger, forholdsvis svake, men fordi det er så mange av dem blir den samlede effekten sterk. Det er disse ladete bindingene som gir vannet mange av de utrolige egenskapene det har. Et av dem er vannets evne til å eksistere i alle tre tilstander – fast form, væske og gass – under den temperaturen og det trykket man kan oppleve på Jorda.
Den midlertidige forbindelsen mellom vannmolekylene gjør at de holder seg som væske over et temperaturspenn på minst 100 grader celsius, til og med mer dersom vannet er salt eller under trykk. Dette gjør at Jordas elver og hav holder seg stabile selv om klimaet veksler. Vi har været vårt fordi vann kan fryse, tine, fordampe og kondensere innenfor de normale temperaturene på Jorda. Vannmolekyler kan lage inntil fire forskjellige forbindelser med sine naboer, men i væskeform skjer det nesten aldri.
Når vannet kjøles ned til under null grader, kan imidlertid molekylene stille seg opp på rekke og danne faste krystaller som gjør disse bindingene enda sterkere. Krystallstrukturen har mange huller, og det gjør frosset vann mindre tett og altså lettere enn flytende vann. Derfor kan isen flyte. Denne egenskapen er avgjørende for at vannet skal kunne opprettholde Jordas klima, og for å opprettholde livet slik vi kjenner det. Hvis isen ikke kunne flyte, ville innsjøene fryse fra bunnen og opp og bli helt kompakte i løpet av en lang og kald vinter.
Vann er også et av de beste løsemidlene i det universet vi kjenner. Fordi molekylene har to poler, kan vannet løse opp andre ladede partikler, og til og med uladede partikler under de rette omstendighetene. Dette får mange konsekvenser, fra endring av planetens geologi, til å bringe biologiske molekyler nær nok til at livets kjemi oppstår. Vann er livsviktig for livet slik vi kjenner det, og så lenge vi har utviklet oss på denne vannholdige planeten, har vi klart å utnytte vannets krefter til å oppnå utrolige ting.
Hva er vann?
Vann består av to ulike atomer; hydrogen og oksygen. Hvert molekyl inneholder ett oksygenatom og to hydrogenatomer som befinner seg 107,5 grader fra hverandre.
Det er oksygenet og hydrogenet som gir vannet dets unike egenskaper. Oksygen er elektronegativt – det har en evne til å tiltrekke seg negativt ladede elektroner. Derfor trekker det til seg elektronene i de to hydrogenatomene. Siden vannmolekylet er bøyd, blir det derfor positivt ladet på hydrogensiden og negativt ladet på oksygensiden.
Vann i kroppen
Mer enn halve kroppen din består av vann, og alt som skjer inni deg er avhengig av det.
Vann er det løsemiddelet som gjør at biokjemiske prosesser kan inntreffe. Det løser opp de kjemiske byggeklossene i cellene, og forbereder dem på transport og byggearbeid.
Uten vann ville kroppen raskt begynne å svikte. Virkningen er merkbar når man mister kun to prosent av kroppens totale vannmengde, og hvis den faller mer enn 15 prosent, kan det være livsfarlig. Med mindre vann i blodet må hjertet jobbe hardere. Økte saltnivåer vil gi muskelkramper, og væsketap i hjernen fører til hodepine, svimmelhet og forvirring. Etter hvert vil mange organer slutte å fungere.
Hvordan vi bruker vann
Livet vårt har vært knyttet til vann helt siden begynnelsen.
Det er ingen tilfeldighet at byer som London, Paris og New York ligger ved elver. Vi er avhengige av vann for å kunne overleve. I millioner av år har forfedrene våre jaktet på denne dyrebare ressursen, men for noen få tusen år siden satte det moderne mennesket navn på det.
Den største kulturelle utviklingen som endret forholdet vårt til vann, var jordbruket. Fra ca. 10 000 år f.Kr. sluttet menneskene gradvis å jakte og sanke, og begynte å dyrke avlinger og holde buskap. Innovative bønder i det gamle Egypt og Mesopotamia gravde dreneringsgrøfter og kanaler for å regulere vannforsyningen til jordene, og Kinas lengste elv Chang Jiang, ble tilpasset for å lage rismarker for dyrking av ris.
Denne infrastrukturen banet vei for utvidelsen av lokale bosettinger, og etter hvert som vannbaserte lokalsamfunn samarbeidet for å takle perioder med flom og tørke, ble tørrlagte områder forvandlet til produktive oaser. Muligheten til å utvikle jorda og dyrke mat for å dekke, eller til og med overgå behovet for mat, har vært grunnvollen i utviklingen av den moderne verden. Til dags dato står jordbruket fremdeles for det største enkeltstående forbruket av vann på kloden og utgjør nesten tre fjerdedeler av vannet vi bruker hver dag.
Vannet har alltid vært brukt til transport og oppdagelsesferder, og det fraktet våre forfedre og deres eiendeler til alle verdenshjørner. Dette la grunnlaget for verdensomspennende handel og utveksling av ideer og banet vei for utvikling av ny teknologi, for eksempel vannhjulet. Vannhjulet ble først brukt til å flytte vann fra ett sted til et annet, og ble senere benyttet til å utføre arbeid. De gamle grekerne var noen av de første til å utnytte vannhjulets til å male korn for mer enn 2000 år siden. Innen 1880 hadde denne teknologien blitt utviklet så vi kunne produsere elektrisitet til lamper, og i dag har vi videreutviklet det gode gamle vannhjulet til moderne hydroelektriske turbiner.
Oppfinnelsen av vannhjulet førte til utviklingen av pumper og ventiler, og da den første pålitelige dampmotoren ble bygget i 1775, førte det til den industrielle revolusjonen som endret verden for alltid. I dag benytter industrien rundt 20 prosent av vannet som brukes hver dag, og det er avgjørende for produksjonen av energi og varer. Det er bare en liten mengde vann som brukes i hjemmet av deg og meg. Mye av det går til vasking og hygiene – og utrolig nok er det bare én prosent av vårt daglige ferskvannsforbruk som faktisk drikkes.
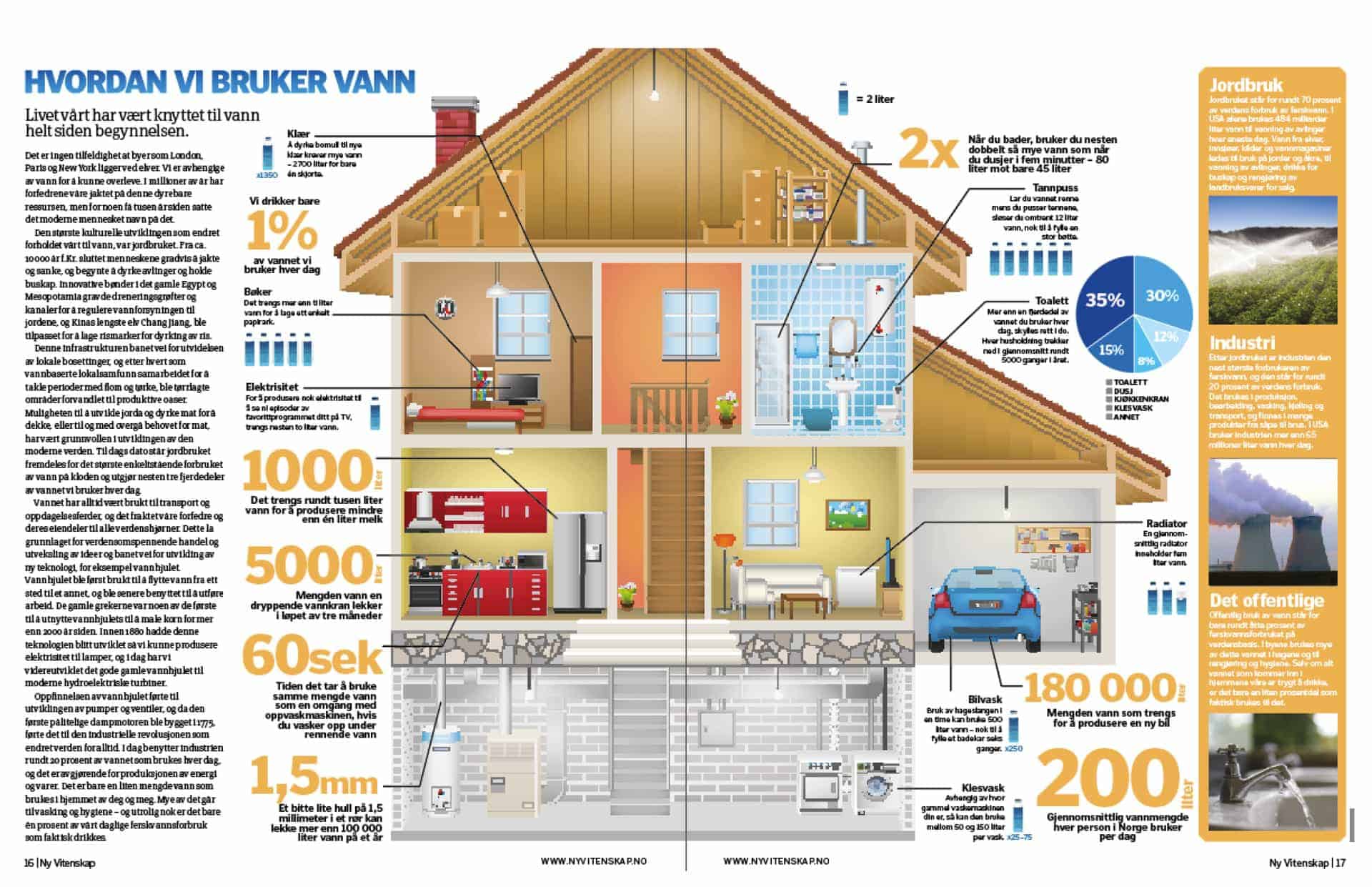
Vannets kretsløp
Vannet vi ser på Jorda i dag er det samme vannet som var der på dinosaurenes tid. Det resirkuleres hele tiden gjennom et sirkulasjonssystem som drives av Sola. Om dagen blir vannet på jordoverflaten oppvarmet. Etter hvert som molekylene utnytter energien, begynner de å rive seg løs fra hydrogenbindingene som holder dem tett sammen, og de blir til vanndamp.
Dampen fraktes opp i atmosfæren av stigende luftstrømmer, og den kjøles ned når den kommer høyere opp. Dampen begynner å kondensere til vanndråper, som igjen samler seg i store skyer. Luftstrømmer høyt i atmosfæren transporterer skyene rundt på kloden og blåser vanndråpene langt bort fra utgangspunktet. Etter hvert som mer vanndamp kondenserer, blir skyene gradvis altfor tunge til å henge på himmelen. Avhengig av temperaturen vil vannet til slutt falle tilbake på bakken som regn, hagl eller snø.
Dette vannet kan falle rett i en elv eller et hav, eller det kan begynne på en mer komplisert vei tilbake til starten på vannets kretsløp. Mye av vannet som treffer bakken, renner rett ut i nærmeste vannmasse. Noe siver ned i jorda og suges opp av tørste planter, og noe renner ned i grunnvannet. Noe vann fryser på toppen av isbreer og når det smelter, siger det sakte ned mot bunnen og kommer ut gjennom en åpning nederst i breen. Men til slutt vil alt vann finne veien tilbake til start.
Vann i verdensrommet
Liv og vann er uløselig knyttet sammen. Livet som vi kjenner det, trenger et løsemiddel for å kunne eksistere – en transportør i væskeform som kan løse opp biologiske molekyler og sørge for at de kommer i kontakt med hverandre. Det er starten på den livgivende kjemiske prosessen. Vann er det eneste molekylet vi vet om, som kan gjøre dette.
Vann er ganske ulikt alle andre løsemidler i det universet vi kjenner. Den kjemiske oppbyggingen som gjør at den ene siden av hvert molekyl er positivt ladet og den andre siden av hvert molekyl er negativt ladet, gjør at vannmolekylene tiltrekker seg alt annet med positiv eller negativ ladning. Dette gjelder både andre vannmolekyler og andre ladede partikler, for eksempel salter.
Det finnes andre væsker som kan fungere som mulige biologiske løsemidler, blant annet metan, men ingen er helt som vann. Fordi vann er elektrolytisk og molekylene er ladede, kan det holdes sammen som væske ved temperaturer der andre liknende molekyler hadde gått over til gassform. Vann holder seg som væske over et relativt stort temperaturområde, en egenskap som har vært livsviktig for utviklingen av liv på Jorda.
Hvis metan skal finnes i væskeform, må temperaturen være lavere enn -161 grader celsius. Det finnes metansjøer på Saturns måne Titan, men molekylene beveger seg så lite rundt når det er så kaldt, at eventuelle biologiske reaksjoner ville skje i ekstremt sakte.
At vi fikk vann på Jorda var det som gjorde det mulig for liv å utvikle seg. Den tidlige jordkloden var varm og ugjestmild, men rundt 400–600 millioner år etter at den ble dannet, begynte ting å forandre seg. Denne perioden er kjent som den sene, tunge bombardement-tiden. Jorda ble pepret med steiner og is som ble slynget mot oss fra det ytre solsystemet av den sterke tyngdekraften i samspillet mellom Jupiter, Saturn, Neptun og Uranus. Steinene hadde med seg is som smeltet til flytende vann.
Alt liv som er oppdaget på Jorda så langt, er avhengig av dette vannet for å eksistere. Derfor prioriterer forskerne å lete etter vann i væskeform, når de jakter på liv andre steder i solsystemet. Hvis forholdene på andre planeter eller måner ligger til rette for det, kan vannet ha inneholdt utenomjordisk liv en gang i fortiden, kanskje helt fram til vår tid.